Forschung
Ortsspezifische Konjugatsynthese
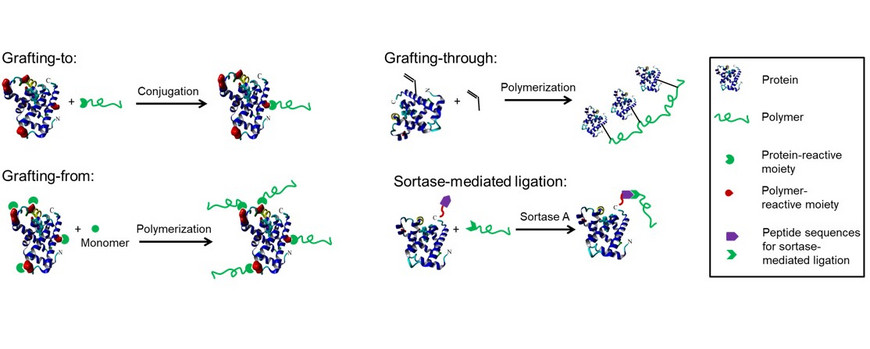
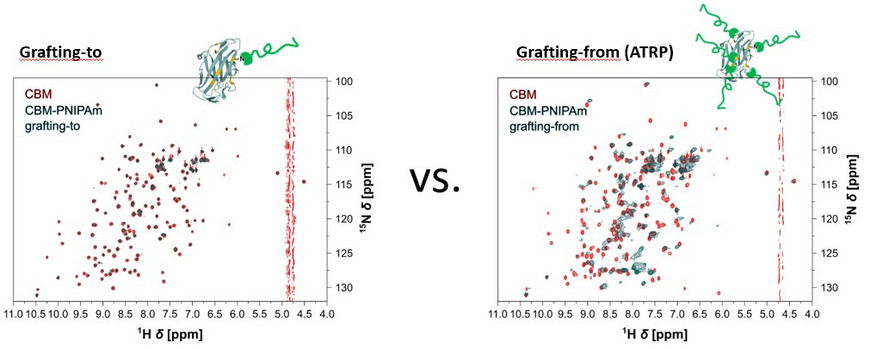
Für die Synthese von Protein-Polymer-Konjugaten werden in der Regel zwei Verfahren angewandt: grafting-to und grafting-from. Bei grafting-to wird das Polymer zuerst synthetisiert und anschließend an das Protein konjugiert. Bei grafting-from wird ein Polymerisationsinitiator oder -mediator an das Protein gebunden und die Polymere anschließend direkt von der Proteinoberfläche gepfropft. Die dritte, selten angewandte Technik, das grafting-through, besteht aus der Polymerisation von Peptid- oder Proteinmonomeren, um mehrere Biomoleküle in das Polymergerüst einzubauen. Grafting-to und grafting-from haben eine geringe Spezifität, insbesondere wenn die häufig vorkommenden Lysinreste adressiert werden. Enzymatische Strategien sind ein vielversprechender Ansatz für eine ortsspezifische Polymeranbindung. Wir verwenden derzeit die Sortase-vermittelte Ligation (SML) für die C- oder N-terminale Modifikation von Proteinen.
Macromol. Biosci., 2025, 25, 2400316
RSC Adv., 2019, 9, 4700
Polym. Chem., 2015, 6, 5143
Stabilisierung von Enzymen
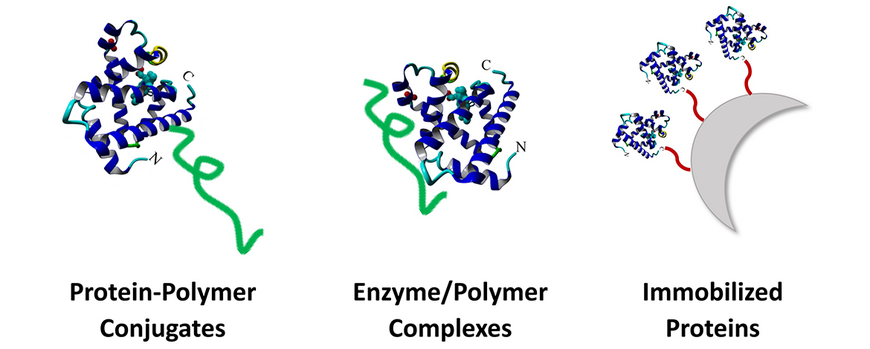
Enzyme sind aufgrund ihrer hohen Spezifität, Vielseitigkeit und Anpassungsfähigkeit sehr attraktive Alternativen zu herkömmlichen Katalysatoren. Jedoch sind Enzyme empfindliche Biomoleküle, die durch unnatürliche Bedingungen wie hohe Temperaturen und hohe oder niedrige pH-Werte schnell inaktiviert werden können. Unser Ziel ist es, Enzyme durch synthetische Polymere so zu stabilisieren, dass sie auch bei höheren Temperaturen und über längere Zeiträume eingesetzt werden können, ohne ihre Aktivität zu verlieren. Unsere Ansätze umfassen die kovalente Konjugation von Polymeren an Enzyme, die Ausbildung nicht-kovalenter Enzym/Polymer-Komplexe und die Immobilisierung der Biokatalysatoren auf polymeren Trägermaterialien. Während die Polymerkonjugation und -komplexierung die Stabilität und Aktivität verbessern können, erlaubt die Immobilisierung darüber hinaus das Abtrennen und Wiederverwenden der Enzyme.
Kooperationspartner:
Prof. Dr. Leilei Zhu, Tianjin Institute of Industrial Biotechnology TIB, China
Dr. Antje Lieske, Fraunhofer-Institut für Angewandte Polymerforschung IAP, Potsdam
Dr. Mehdi D. Davari, Leibniz-Institut für Pflanzenbiochemie IPB, Halle
Prof. Dr. Katja Arndt, Universität Potsdam
Dr. Martin Reifarth, Universität Potsdam
ChemCatChem, 2024, 16, e202301685
Angew. Chem. Int. Ed., 2018, 57, 13810
Therapeutische Protein-Polymer-Konjugate
Die hohe Spezifität von Proteinen kann für therapeutische Anwendungen im Vergleich zu niedermolekularen Wirkstoffen von Vorteil sein. Therapeutische Proteine werden jedoch häufig vom Immunsystem erkannt und schnell wieder aus dem Körper entfernt. In den 1970er Jahren wurde festgestellt, dass die Konjugation von Poly(ethylenglykol) (PEG), heute als PEGylierung bekannt, ein Protein abschirmen kann. Dadurch wird die Immunogenität verringert und das Protein ist weniger anfällig für thermische Denaturierung, Aggregation und Abbau durch Proteasen. Viele der rund 20 klinisch zugelassenen Protein-PEG-Konjugate weisen jedoch eine verminderte Aktivität auf, die hauptsächlich auf die zufällige Konjugation des Polymers an unterschiedliche Aminosäurereste im Protein zurückzuführen ist. Darüber hinaus zeigt die verstärkte Entwicklung von Anti-PEG-Antikörpern, die zu einer schnellen Ausstoßung von PEGylierten Substanzen führen, dass andere Polymere für zukünftige therapeutische Konjugate in Betracht gezogen werden sollten. Wir nutzen unser Portfolio an Protein-Polymer-Konjugationsstrategien, um besser zu verstehen, wie die Stabilisierung von therapeutischen Proteinen optimiert werden kann. Auf der einen Seite vergleichen wir verschiedene Konjugationsansätze hinsichtlich ihrer Auswirkungen auf Proteinstrukturen und -funktionen. Andererseits synthetisieren wir verschiedene Polymere, die als Alternativen zu PEG gelten, und setzen sie in therapeutischen Konjugaten ein.
Kooperationspartner:
Prof. Dr. Heiko Möller, Universität Potsdam
Prof. Dr. Katja Arndt, Universität Potsdam
Macromol. Chem. Phys., 2023, 224, 2200353
J. Drug Deliv. Sci. Technol., 2023, 79, 103995
Konjugate zur Inhibierung von Viren
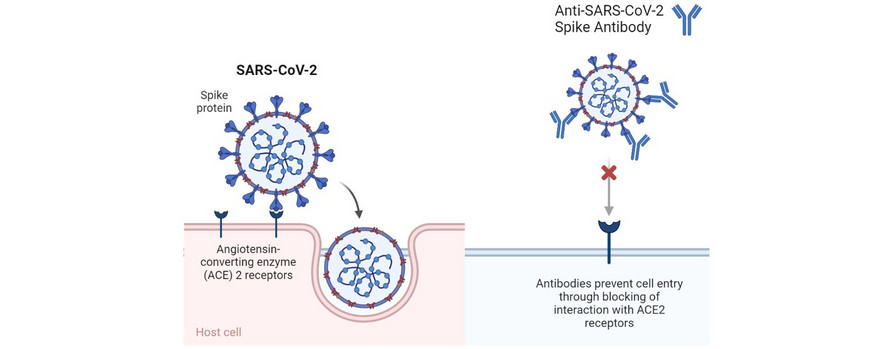
Mit dem Aufkommen von COVID-19 rückten Virusinfektionen in den Fokus der Gesellschaft, der angewandten Forschung und der Grundlagenforschung. Bisher gibt es kaum Medikamente gegen Viruserkrankungen. SARS-CoV-2 gelangt in menschliche Zellen nach Bindung ihres trimeren Spike-Proteins an ACE 2-Rezeptoren. Antikörper, die an Oberflächenproteine von Viren binden und ihre Wechselwirkung mit den ACE 2-Rezeptoren blockieren, sind ein therapeutischer Ansatz. Da die Herstellung von Antikörpern aufwändig und teuer ist, werden Nanobodies, kleine Fragmente von Antikörpern, in der Grundlagenforschung als eine potente Alternative gesehen. Der aus Alpakas gewonnene Nanobody Ty1 zeigte ein hohes Potenzial zur Neutralisierung von SARS-CoV-2. Wir synthetisieren Ty1-Polymer-Konjugate und untersuchen deren Stabilität und Potential zur Virus-Neutralisierung. Dabei zeigte sich ein deutlicher Einfluss des verwendeten Polymers, was zukünftig vielfältige therapeutische Optionen gegen Viruserkrankungen eröffnen könnte.
Kooperationspartnerin:
Prof. Dr. Petra Wendler, Universität Potsdam
Peptid-Polymer-Konjugate zur Bindung von Lanthanid-Ionen
Lanthanide haben eine enorme wirtschaftliche Bedeutung für viele Bereiche der Hightech-Industrie. Sie sind derzeit nur aufwendig und unter Verwendung von umweltgefährdenden Chemikalien zu gewinnen und voneinander zu trennen. Als neuen Ansatz aus der Bioökonomie verwenden wir hochselektive Peptide mit dem langfristigen Ziel, einen Beitrag zu Nachhaltigkeit und Kreislaufwirtschaft zu leisten. Derzeit untersuchen wir, inwiefern die Peptid/Lanthanid-Komplexierung durch Polymerkonjugation und Immobilisierung beeinflusst wird.
Kooperationspartner:
Prof. Dr. Michael Kumke, Universität Potsdam
Prof. Dr. Heiko Möller, Universität Potsdam
Dr. Björn Drobot, Helmholtz-Zentrum Dresden-Rossendorf
Dr. Franziska Lederer, Helmholtz-Zentrum Dresden-Rossendorf
RSC Adv., 2024, 14, 14091
Förderung und Dank
Fraunhofer / UP: Leistungszentrum "Integration biologischer und physikalisch-chemischer Materialfunktionen", Kooperationsprojekte Mat4Water: Materialplattform für die Wasserwirtschaft
DFG: "Biohybride Materialien", Heisenberg-Förderung, 02/2024 - 01/2027, Projektnummer 530253155
BMBF: “Enzymstabilisierung für eine zirkuläre (Bio-)Kunststoff-Wirtschaft” (EnzCircEco), 01/2024 - 12/2026, FKZ 031B1424
BMBF: “Entwicklung und Implementierung eines COVId-19-scFv-TRAP-Portfolios für diagnostische und therapeutische Anwendungen ” (COVITRAP), 11/2021 – 10/2023, FKZ 01DP21012
BMBF: “Lasst die Biologie ran - Peptide umgarnen entscheidende Rohstoffe: die „natürliche“ Trennung von Lanthaniden” (PepTight), 09/2021 – 05/2025, FKZ 031B1122B
Fraunhofer Leistungszentrum "Funktionsintegration": “Sortase-basierte Protein-Polymer und Protein-Nanopartikel Konjugate: Charakterisierung von 3D-Struktur, Dynamik und Interaktion mittels NMR-Spektroskopie”, ab 01/2020
DFG: “Multiple Verknüpfungen mittels Sortase-vermittelter Ligation am Beispiel von Protein-Polymer-Konjugaten”, 01/2019 – 03/2022, Projektnummer 414977640
BMBF: “Chirale Membranen II”, 02/2018 – 01/2021, FKZ 031B0559B